RESUMEN
El papiloma escrotal constituye una alteración frecuente en los sementales porcinos, en Cuba ha sido reportado en centros productivos. El objetivo del trabajo consistió en caracterizar al papiloma escrotal porcino desde el punto de vista clínico patológico e histoquímico. Se utilizaron 15 sementales porcinos con esta afección, algunos papilomas péndulos y de gran tamaño fueron extirpados por el método de biopsia y procesados para su evaluación histoquímica. La observación del tejido y las microfotografías se hicieron con el microscopio óptico Olimpus con cámara incorporada. Las características histoquímicas se describen utilizando las coloraciones EVG y Tricrómica de Van Gieson, concluyendo una gran cantidad de fibras elásticas y colágenas I y III, relacionadas con la presencia de numerosos fibroblastos reactivos, típico de un proceso fibrótico. Los hallazgos histopatológicos sugieren la presencia de fibropapilomas con hiperplasia irregular e hiperqueratosis epidérmica, proliferación de tejido conectivo fibroso intercalado con fibroblastos reactivos y coilocitos.
Descriptores: Papilomavirus porcino; histoquímica; fibrosis escrotal. (Tesauro AGROVOC).
ABSTRACT
Scrotal papilloma is a frequent alteration in swine stallions and has been reported in Cuba in productive centers. The objective of this work consisted in characterizing porcine scrotal papilloma from the clinicopathological and histochemical point of view. Fifteen swine stallions with this condition were used, some pendulous and large papillomas were excised by biopsy method and processed for histochemical evaluation. Tissue observation and microphotographs were made with the Olimpus optical microscope with built-in camera. Histochemical features are described using EVG and Van Gieson's Trichrome stains, concluding a large amount of elastic and collagen I and III fibers, related to the presence of numerous reactive fibroblasts, typical of a fibrotic process. Histopathological findings suggest the presence of fibropapillomas with irregular hyperplasia and epidermal hyperkeratosis, proliferation of fibrous connective tissue interspersed with reactive fibroblasts and coilocytes.
Descriptors: Porcine papillomavirus; histochemistry; scrotal fibrosis. (AGROVOC Thesaurus).
INTRODUCCIÓN
La verruga escrotal o papiloma constituye una alteración frecuente en los sementales porcinos, y en Cuba ha sido reportado por Ramírez et al. (2004) en centros especializados del Occidente. La papilomatosis cutánea es una enfermedad crónica, causada por un virus de la familia Papillomaviridae, género Papillomavirus. Es un virus que produce múltiples lesiones proliferativas de naturaleza fibroepitelial, caracterizadas por la aparición de tumores benignos fibropapilomas, papilomas o verrugas en piel y en mucosas (Jelinek & Tachezy, 2005; Vivas et al., 2015).
Existen pocos referentes sobre el desarrollo del papiloma escrotal, su evaluación clínica y lesional en la especie porcina; sin embargo, esta entidad patológica puede afectar la termorregulación del testículo y su funcionamiento. En los centros especializados de crianza porcina de la región oriental de Cuba, la presencia de estos casos ha ido en aumento, tomando en los últimos años un carácter enzoótico (Castellanos Gutiérrez & Zaldívar Quintero, 2014).
Las características histoquímicas y clínico-patológicas establecen bases importantes para el diagnóstico, estandarización de características morfofisiológicas y tratamiento del papiloma escrotal porcino. Actualmente la técnica histoquímica constituye la herramienta básica para el estudio de cualquier tejido u órgano.
El objetivo del trabajo fue caracterizar el papiloma escrotal porcino partiendo desde el punto de vista clínico-patológico e histoquímico.
MÉTODO
El trabajo se realizó en la Empresa Porcina Granma, en el Laboratorio de Patología del Hospital Ernesto Guevara de la Serna en Las Tunas y en el Laboratorio de Bioquímica de la Facultad de Ciencias Agropecuarias, Universidad de Granma, durante el período comprendido entre los años 2023 – 2024. Se seleccionaron 15 verracos, 5 de raza CC-21, 5 L35 y 5 de raza Duroc, todos con presencia de verrugas escrotales con diferente grado de afectación, sin tratamiento previo de la enfermedad y mayores de 2 años de edad. Estos animales fueron incorporados al régimen de explotación como sementales a los ocho meses con un peso aproximado de 110 Kg. El manejo fue el establecido para estos centros (Manual del IIP, 2008) y consistió en el alojamiento individual en corrales de 3 m de largo por 1,5 m de ancho de área, con un suministro de agua a voluntad mediante bebederos automáticos tipo tetina. La presencia del papiloma se determinó mediante caracterización clínica de la lesión por inspección y palpación del escroto. Para el estudio histoquímico se extrajeron fragmentos tisulares de formaciones verrucosas y piel a través del método de biopsia.
Material utilizado para realizar la biopsia:
- Toxoide tetánico
- Medios de sujeción del animal
- Antisépticos: Tanogen y eosina 0.5 %
- Jeringa 10 mL y aguja 18 G
- Anestésico local (Lidocaína 2 %)
- Sedante (Clorpromazina)
- Torundas estériles
- Guantes estériles
- Hoja bisturí nº 22
- Pinzas hemostáticas
- Mango bisturí nº 4
- Frasco con formol al 10 %.
Procedimiento para la biopsia
Pre-operatorio. Se procedió a la vacunación antitetánica de los verracos 10 días antes de la biopsia. Los sementales se mantuvieron 12 horas en ayunas previo a la toma de muestra.
Trans-operatorio. Se logró una correcta sujeción del verraco, aplicando un torniquete con una soga por debajo de la oreja y detrás de los colmillos y fijado fuertemente a una columna. Para la sedación se empleó clorpromazina, a una dosis de 1.1 mg/kg de PV por vía endovenosa. Luego se preparó el campo operatorio logrando la antisepsia del área entorno a la verruga, se lavó con agua y jabón, se afeitaron los pelos a su alrededor y se aplicó un producto antiséptico (eosina 0.5 %). Se utilizó anestesia por infiltración. Pellizcando la piel escrotal, se realizaron infiltraciones (intradérmica y subcutánea) a ambos lados de la lesión con anestésico local (Lidocaína 2%), calculando a razón de 6 mg/kg de peso corporal en varias administraciones, infiltrando repetidamente pequeñas cantidades de anestésico. Una vez realizada la infiltración se esperó 2-3 minutos mientras se daba un suave masaje sobre la zona con una torunda estéril, para ayudar a la difusión de la anestesia y dar tiempo a que sea efectiva. 25 Las verrugas fueron extirpadas por la base haciendo bordes elípticos. Se limpió la zona y se aplicó como antiséptico el tanogen. Las muestras de tejido verrucoso oscilaron entre 5 y 7 gramos y fueron tomadas con pinzas hemostáticas y sumergidas en formol al 10 % para su fijación en frascos debidamente preparados.
Post-operatorio: El tratamiento post- operatorio consistió en la administración de Penicilina en dosis de 22.000 U.I. por kg de peso durante 5 días y curas locales con Tanogen cada 2 días.
Estudios histoquímicos: Las muestras fueron fijadas en formalina al 10% por 24 horas y llevadas al Laboratorio de Patología del Hospital Ernesto Guevara de la Serna en Las Tunas, donde fueron procesadas hasta su inclusión en parafina. Posteriormente, trasladadas al Laboratorio de Bioquímica de la Facultad de Ciencias Agropecuarias en la Universidad de Granma, donde fueron procesadas para evaluación histoquímica mediante las tinciones de EVG y el tricrómico de Van Gieson, según los procedimientos del Manual de Técnicas Histoquímicas (Pérez, 2015).
La técnica histológica utilizada fue el método de inclusión y corte en parafina. La observación de las lesiones y las microfotografías fueron con un microscopio óptico Olimpus con cámara incorporada. La presencia del papiloma se determinó mediante caracterización clínica de la lesión por inspección y por palpación en escroto. Fue evaluada la presencia de hiperqueratosis, acantosis y la formación de papilas epidérmicas hacia la dermis.
RESULTADOS
Características clínicas del papiloma escrotal porcino
Se encontraron escasos antecedentes del tema en la especie porcina. Las manifestaciones clínicas, las características patológicas de las lesiones y los resultados histoquímicos confirmaron el diagnóstico de papiloma escrotal en los verracos estudiados, de acuerdo con lo reportado como método diagnóstico, consultado y utilizado para enfermedades similares como el papiloma cutáneo de otras especies como el bovino (PCB).
Las manifestaciones clínicas de las lesiones cutáneas se describen como formaciones verrucosas de diverso tamaño y consistencia firme (Figura 1), pediculadas o como coliflor y a veces aparecen como masas hiperpigmentadas (Iglesias y Batista, 2003; Vásqués et al., 2012; Catroxo et al., 2013; Vivas et al., 2015; Cardona et al., 2016).

Figura 1. Formaciones verrucosas de diverso tamaño y consistencia firme.
Elaboración: Los autores.
Los resultados de este trabajo están en consonancia con lo descrito por Baba et al. (2007) refiriéndose a papilas de pequeño a moderado tamaño (1–3 cm) y firmes situadas a nivel escrotal.
Las características macroscópicas similares al papiloma de los verracos estudiados fueron reportadas por Cardona et al., (2016) en otras especies animales como el bovino; con la diferencia de que en cerdos, tienen alta afinidad por la piel del escroto.
De acuerdo con lo planteado por Brooks (2000), estas lesiones provocan una deformación estética que da lugar a una hipofunción cutánea local y adherencias a capas internas del escroto, lo que influye sustancialmente en la termorregulación testicular y por tanto en los indicadores del eyaculado. Por otra parte las lesiones traumáticas que pueden acontecer en las verrugas conllevan a infecciones de otra índole y con influencia sistémica.
En los animales con más desarrollo lesional verrugoso, se observó mayor predisposición a infecciones en la vecindad, como refiere Albarrán et al (2001) y Chamizo (2004).
En el desarrollo de este trabajo se observó cómo crecen los papilomas y progresan rápidamente hacia una queratinización notable con oscurecimiento de la zona, conforme a lo visto por Vivas et al. (2015) y Cardona Álvarez et al. (2018) que indican que los papilomas crecen en forma de nódulos y se cornifican gradualmente, por lo que pueden llegar a ser de diferentes formas.
Asimismo, Catroxo et al. (2013) explican que los papilomas más oscuros y bastante queratinizados se desprenden de la piel, siendo invadidos por infecciones secundarias, en casos relacionados con este trabajo, las infecciones secundarias derivan de traumas y daños del papiloma.
Hallazgos histoquímicos en el fibropapiloma escrotal del verraco
Los hallazgos histoquímicos con la coloración de EVG corresponden con los reportados en la literatura, para el diagnóstico del papiloma, siendo las papilas epidérmicas, la hiperplasia epitelial y la acantosis el hallazgo más común coincidiendo con Iglesias & Batista (2003); Monteiro et al. (2008); Vázquez et al. (2012). Analizando las características clínicas del papiloma, se avinieron con los hallazgos histopatológicos encontrados en todas las muestras estudiadas, constituyendo un aporte importante para el diagnóstico de esta condición patológica (Figura 2).
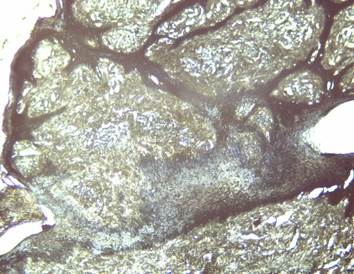
Figura 2. Hiperplasia epitelial y acantosis con proyecciones hacia la dermis e hiperqueratosis. Las fibras colágenas se observan en gris oscuro, los fibroblastos en azul. Coloración EVG 10X.
Elaboración: Los autores.
En la coloración se evidenció abundante proliferación dérmica de colágeno; con áreas de birrefringencia rojiza y verde amarillenta, indicando presencia de colágeno maduro tipo I y tipo III; lo que podría indicar la buena respuesta regenerativa del organismo frente al proceso de progresión de células infectadas con el agente etiológico, siendo estas técnicas utilizadas por Cardona et al. (2013a; 2013b) como indicador del grado de respuesta de reparación de tejidos en estados agresivos cutáneos.
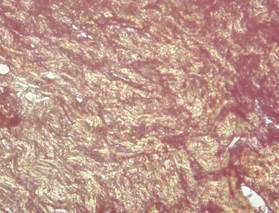
Figura 3. Marcadas
áreas de birrefringencia rojiza, lo que indica presencia de colágeno maduro
tipo I (color rojo brillante) y moderada presencia de colágeno tipo III (color
verde-amarillento). Coloración EVG 40X.
Elaboración: Los autores.
La birrefringencia verde-amarillenta de las fibras observadas en la Figura 3, indica presencia de colágeno maduro tipo I. Existe policromía y al corte histológico no es homogéneo.
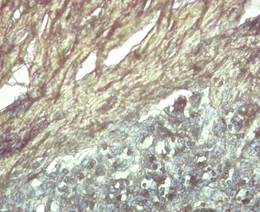
Figura 4. Coilocitosis en células epiteliales de la verruga y presencia de colágeno tipo I con birrefringencia verde amarillo en la dermis. Policromía y falta de homogeneidad del tejido. Coloración EVG 40X.
Elaboración: Los autores.
De igual forma, se observó vacuolización nuclear en el estrato espinoso de la epidermis (coilocitosis). En la coloración de Tricrómico de Van Gieson, donde se utiliza hematoxilina alcohólica, 10 % de cloruro férrico además de lugol, se 30 observó marcada proliferación dérmica de colágeno desorganizados con escasa presencia de tejido conjuntivo difuso (Figura 4).
Tal como plantearon Borzacchiello et al. (2008), histológicamente las lesiones causadas por papilomas son acantosis extensivas, desiguales y excrecencia epitelial. Las inclusiones intracitoplasmáticas, grandes, esféricas con manchas ácidas, a menudo rodeado por un halo

Figura 5. Marcada proliferación dérmica de colágenos desorganizados, con escasa presencia de tejido conjuntivo difuso. Coloración Tricrómico de VanGieson 4 X.
Elaboración: Los autores.
Durante la segunda etapa de la técnica histoquímica donde se lava la muestra y se aplica fucsina ácida y ácido pícrico saturado, se observan numerosos fibroblastos con núcleos azules (Figura 5), mientras que las fibras colágenas toman una tonalidad gris o negra. Se observa proliferación de fibras elásticas coloreadas también de negro pero más delgadas que las colágenas. En esta figura se observa que las fibras colágenas predominan en la periferia de la lesión, mientras las elásticas se concentran alrededor de los vasos sanguíneos, típico de los fibrohemangiomas. La gran proliferación de fibroblastos indica la reactividad del tejido conjuntivo ante la presencia de un agente etiológico, lo cual conduce a la intensa proliferación de colágeno e instaurándose en la dermis escrotal un proceso fibrótico. (Figura 5). Este resultado es compatible con lo reportado por Méndez Rodriguez et al. (2021).
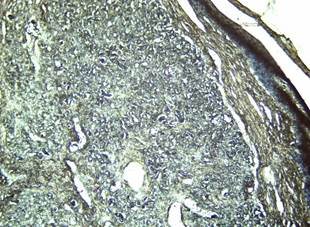
Figura 6. Hiperqueratosis epidérmica y en la dermis se observan numerosos fibroblastos (núcleos azules), fibras colágenas, más abundantes hacia la periferia de la lesión, y fibras elásticas (más delgadas), alrededor de los vasos sanguíneos, todas con tonalidad gris o negra. ColoraciónTricrómico de Van Gieson 4 X.
Elaboración: Los autores.
Con las técnicas histoquímicas se evaluó la cantidad y distribución de las fibras colágenas y elásticas de la zona dérmica en el papiloma escrotal porcino. En todas las porciones del tejido dérmico papilomatoso se encontraron fibras elásticas dispuestas en todas direcciones, siguiendo la misma distribución de las fibras colágenas. Se encontraron diferencias significativas entre la cantidad de fibras colágenas y elásticas presentes en las zonas evaluadas, lo que sugiere que el rol de las fibras colágenas es preponderante para adaptarse a las nuevas condiciones funcionales de la formación papilomatosa. Así mismo estos resultados muestran que intercalado con el tejido conjuntivo denso aparecen zonas de tejido conectivo laxo con escasa cantidad de fibras colágenas (Figura 6).
Los resultados de este trabajo coinciden con lo observado por Maclachlan y Dubovi (2017) quienes plantean que este proceso induce a hiperplasia de las células basales y retardan la maduración de estas para llegar a los estratos espinoso y granuloso.
Estos resultados confirman lo referido por Paciello et al. (2009) quienes confieren la importancia de las técnicas histoquímicas que demuestran la naturaleza no uniforme del tejido señalando las características bioquímicas de un tipo específico de fibra y su rol en el desarrollo de los procesos patológicos y muestran cambios estructurales en las fibras que no son evidentes con las tinciones no enzimáticas utilizadas de rutina.
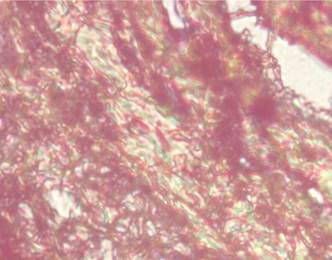
Figura 7. Intercalado con el tejido conjuntivo denso (oscuro) aparecen zonas de tejido conectivo laxo (claro) con escasa cantidad de fibras colágenas. Coloración Tricrómico de Van Gieson 40 X.
Elaboración: Los autores.
Se observó gran cantidad de fibras colágenas, distribuidas alrededor de los vasos sanguíneos, participando de su función mecánica (Figura 7).
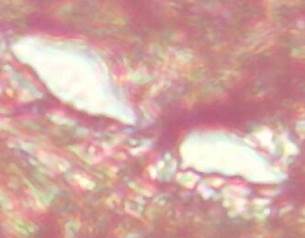
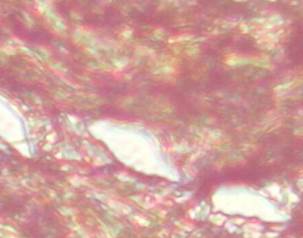
Figura 8. Gran
cantidad de fibras elásticas, distribuidas en manojos y alrededor de los vasos
sanguíneos. Coloración Tricrómico de Van Gieson 40 X.
Elaboración: Los autores.
Las imágenes muestran resultados coincidentes con las lesiones descritas por Chuagui (2010), y Castellanos Gutiérrez & Zaldívar Quintero (2014), quienes explican que la lesión vascular angiomatosa se caracteriza por un conjunto de vasos capilares, venosos y arteriales con fuerte engrosamiento de sus paredes (Figura 8).
La cantidad de
fibras elásticas y colágenas en la dermis papilomatosa escrotal es mucho mayor
y más desorganizada que la dermis sana de la piel. No se encontraron reportes
del uso de técnicas histoquímicas para este tipo de papiloma en cerdos, lo que
puede constituir un motivo importante para continuar investigando en apoyo al
diagnóstico y pronóstico de esta entidad patológica.
CONCLUSIONES
El papiloma escrotal porcino se describe clínicamente como formaciones verrucosas de tamaño variable y consistencia firme, con marcada afinidad por el tejido escrotal, generalmente pediculadas o en forma de coliflor, hiperqueratinizadas e hiperpigmentadas, muchas veces mostrando infecciones secundarias de orígen traumático.
La caracterización histoquímica del papiloma escrotal porcino ante la coloración Tricrómico de Van Gieson evidenció áreas de birrefringencia rojiza y verde amarillenta, indicando presencia de colágeno maduro tipo I y III.
Los resultados histoquímicos permitieron observar en el papiloma escrotal porcino numerosos fibroblastos activos, coilocitosis en células epiteliales, policromía y falta de homogeneidad del tejido, típico de un proceso fibrótico.
FINANCIAMIENTO
No monetario.
AGRADECIMIENTO
A la Universidad de Granma por el apoyo en la presente investigación.
REFERENCIAS CONSULTADAS
Albarrán, I., Rubiera, G., & Calderon, R. (2001). Inseminación artificial y Andrológica veterinaria. La Habana: Editorial Felix Varela.
Baba, A., & Catoi C. (2007). Female Genital Tract Tumors. Comparative Oncology. Bucharest, Romania: The Publishing House of the Romanian Academy.
Borzacchiello, G., & Roperto, F. (2008). Bovine papillomaviruses, papillomas and cancer in cattle. Rev. Vet. Res. 39(5). https://dx.doi.org/10.1051/vetres:2008022
Brooks, D. (2000). Piel y sistema tegumentario. Verrugas Infecciosas. Papilomas. En: El Manual Merck de Veterinaria. (5ta Ed). (pp. 772-786) Madrid, España: Ed. Océano.
Cardona Álvarez, J., Montes Vergara, D., & Álvarez Peñate, J. (2018). Caracterización clínica, histopatológica e histoquímica del papiloma cutáneo en bovinos (bos taurus) del departamento de Córdoba, Colombia [Clinical, histopathological and histochemical characterization of cutaneous papillomatosis in bovine (bos taurus) of Córdoba department, Colombia]. Revista U.D.C.A Actualidad & Divulgación Científica, 21(1), 137-146. https://doi.org/10.31910/rudca.v21.n1.2018.672
Cardona Álvarez, J., Vargas Vilória, M., & Paredes Herbach, E. (2016). Clinical and histopathological study of the phototoxic dermatitis in Zebu calves in grazing of Brachiaria decumbens. Revista MVZ Córdoba, 21(2), 5366-5380. https://doi.org/10.21897/rmvz.603
Cardona, J., Vargas, M., & Perdomo, S. (2013a). Estudio clínico e histopatológico del carcinoma de células escamosas de bovinos en el Departamento de Córdoba, Colombia [Clinical and Histopathological Study of the Squamous Cell Carcinoma in Cattle of the Cordoba Department, Colombia]. Rev. Fac. Cs. Vets. UCV, 54(2), 68-77. https://n9.cl/u9url
Cardona, J., Vargas, M., & Perdomo, S. (2013b). Estudio clínico e histopatológico del sarcoide fibroblástico en burros (Equus asinus) en Colombia [Clinical and Histopathologic Study of the Fibroblast Sarcoid in Donkeys (Equus asinus) in Colombia]. Revista Científica, FCV-LUZ XXIII (2):97-104. https://n9.cl/2nn16
Castellanos Gutiérrez, O. C., & Zaldívar Quintero, N. (2014). Características clínico citológicas del fibrohemangioma escrotal porcino. Vet. Arg, XXXI(313). https://n9.cl/a9v7e
Catroxo, M., Martins, A., Petrella, S., Souza, F., & Nastari, B. (2013). Ultrastructural Study of Bovine Papillomavirus During Outbreaks in Brazil. International J. Morph, 31(2), 777-784. http://dx.doi.org/10.4067/S0717-95022013000200068
Chamizo, P. (2004). Neoplasias. Piel [Neoplasms. Skin]. En: Patologías Orgánicas y Enfermedades de los Animales Domésticos (pp. 136-137). La Habana, Cuba: Editorial Félix Varela.
Chuagui, B., & González, S. (2010). Neoplasias. En: Manual de Patología General. Universidad Católica de Chile. Impreso en España.
Iglesias, A., & Batista, L. (2003). Caracterização anatomopatológica da papilomatose cutânea em bovinos leiteiros [Anatomopathologic caracterization of cutaneous papillomatosis in dairy Cattle]. Rev. Bras. Ciênc. Vet. 10(3),161- 165. http://dx.doi.org/10.4322/rbcv.2015.293
Jelinek, F., & Tachezy, R. (2005). Cutaneous papilomatosis in cattle. Rev. J. Comp. Pathol, 132, 70-81. https://doi.org/10.1016/j.jcpa.2004.07.001
Maclachlan, N. J., & Dubovi, E. J. (2017). Chapter 11 - Papillomaviridae and Polyomaviridae. En: Fenner's Veterinary Virology. (5th. ed.). (pp. 229-243). Burlington, MA: Academic Press. https://doi.org/10.1016/B978-0-12-800946-8.00011-8
Méndez Rodriguez, I., Tenería Muñoz, F. A., González Hernández, M, Martínez Castellanos, A. Y., & Hernández Arteaga, L. E. (2021). Características histopatológicas y detección de Papilomavirus en la fibropapilomatosis bovina en el estado de San Luis Potosí, México [Histopathology and PCR detection of bovine fibropapillomatosis in cattle in San Luis Potosí, Mexico]. Revista Mexicana de Ciencias Pecuarias, 12(1), 286-297. https://doi.org/10.22319/rmcp.v12i1.5999
Monteiro, V. C., Cardoso Coelho, M. C. O., Carneiro, A. da S., de Araújo Silva, R. A., Teixeira, M. N., Wanderley, A. G., Wanderley, E. K., & Franco, E. D. S. F. (2008). Descrição clínica e histopatológica da papilomatose cutânea bovina (BPV) [Clinical and histopathological description of bovine cutaneous papillomatosis (BPV)]. Ciência Animal Brasileira / Brazilian Animal Science, 9(4), 1079–1088. https://doi.org/10.5216/cab.v9i4.1181
Paciello, O., & Papparella, S. (2009). Histochemical and Immunohistological approach to comparative neuromuscular diseases. Folia Histochem Cytobiol, 47(2),143-152. https://doi.org/10.2478/v10042-009-0066-3
Pérez, G. (2015). Manual de Técnicas Histoquímicas. Unidad Anatomía Patológica. Hospital Regional Rancagua. Chile.
Ramírez, M, & Chamizo, F. (2004). Informe preliminar de fibroma escrotal porcino [A preliminary report of scrotal fibroma in pigs]. Revista computarizada de producción porcina, 11(1), 43-48. https://n9.cl/k4xl2
Vázquez Díaz, R., Escudero Duch, C., Doménech Gómez, A., Gómez-Lucía Duato, E. & Benítez Rico, L. (2012). Papilomatosis bovina: epidemiologia y diversidad de papilomavirus bovino(BPV) [Bovine papillomatosis: epidemiology and diversity of bovine papillomavirus (BPV)]. Rev. Complut. Cienc.Vet., 6(2), 38-57. http://dx.doi.org/10.5209/rev_RCCV.2012
Vivas, R., Cordero, L., Ruiz, E., Cárdenas, M., Melina, M., & Navarro, R. (2015). Papilomatosis bovina en el trópico mexicano: presentación clínica y control. Bioagrociencias, 8(1), 45-52.
©2024 por los autores. Este artículo es de acceso abierto y distribuido según los términos y condiciones de la licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional (CC BY-NC-SA 4.0) (https://creativecommons.org/licenses/by-nc-sa/4.0/).