http://dx.doi.org/10.35381/a.g.v3i5.1658
Extracción de pectina mediante hidrolisis ácida de la cáscara de cambur (Musa paradisiaca)
Extraction of pectin by acid hydrolysis of banana peel (Musa paradisiaca)
Universidad Nacional Experimental Francisco de Miranda, Falcón
Venezuela
https://orcid.org/0000-0001-7203-3723
Betsay María Toyo-Fernández
Universidad Nacional Experimental Francisco de Miranda, Falcón
Venezuela
https://orcid.org/0000-0001-9679-747X
María Eugenia Moreno Quintero
Universidad Nacional Experimental Francisco de Miranda, Falcón
Venezuela
https://orcid.org/0000-0003-2254-7739
Recibido: 01 de abril 2021
Revisado: 20 de mayo 2021
Aprobado: 15 de junio 2021
Publicado: 01 de julio 2021
RESUMEN
La presente investigación, tuvo como objetivo extraer de pectina mediante hidrolisis ácida de la cáscara de cambur (Musa paradisiaca). Se emplearon cáscaras de color amarillo y se analizaron de forma fisicoquímica. La extracción, se realizó con ácido clorhídrico concentrado a las siguientes condiciones: pH (2,2; 5 y 3), el tiempo (45; 60 y 75 min) y la temperatura (80; 85 y 90 ºC); como variable respuesta el rendimiento. El análisis fisicoquímico reportó: humedad 89,8%±0,4, pH 4,8±0,3, proteína cruda 4,3%±0,5, extracto etéreo 5,5%±0,3, azúcares totales 12,7%±0,2, azúcares solubles 5,5%±0,08 y cenizas totales 13,46%±0,07. El análisis de superficie de respuesta precisó, que las condiciones del proceso son: temperatura 85ºC, pH 2 y tiempo 75min para un rendimiento de 13,87%. La pectina obtenida, es de gelificación rápida y de alto metóxilo, esto indica que es viable la extracción de esta sustancia a las condiciones estudiadas.
Palabras Clave: Cambur; hidrólisis; pectinas. (Tesauro AGRAVOC).
ABSTRAC
The objective of this research was to extract pectin by acid hydrolysis of banana peel (Musa paradisiaca). Yellow husks were used and analyzed physicochemically. The extraction was carried out with concentrated hydrochloric acid at the following conditions: pH (2.2, 5 and 3), time (45, 60 and 75 min) and temperature (80, 85 and 90 ºC); performance as a response variable. The physicochemical analysis reported: humidity 89.8%±0.4, pH 4.8±0.3, crude protein 4.3%±0.5, ether extract 5.5%±0.3, total sugars 12,7%±0.2, soluble sugars 5.5%±0.08 and total ashes 13.46%±0.07. The response surface analysis specified that the process conditions are: temperature 85ºC, pH 2 and time 75min for a yield of 13.87%. The obtained pectin is of rapid gelation and high methoxyl, this indicates that the extraction of this substance is viable under the conditions studied.
Keywords: Cambur; hydrolysis; pectins. (AGRAVOC Thesaurus).
INTRODUCCIÓN
En los últimos años, se ha evidenciado el interés en el estudio de residuos vegetales con miras a su aprovechamiento para la generación de productos de interés económico y social. Esto se debe a su composición química variada, por lo que son una fuente importante de sustancias que pueden ser utilizadas debido a sus propiedades favorables, tecnológica o nutricionalmente, para su conversión o extracción de un producto útil de mayor valor agregado que además de solucionar un problema, genere ingresos económicos adicionales (Vargas y Pérez, 2018).
Estudios demuestran la factibilidad de utilizar residuos vegetales como cortezas, para múltiples fines refiriendo a las pectinas muy utilizado en el campo de la industria alimenticia (Vargas y Pérez, 2018). Entre los materiales aprovechados se mencionan: cáscara de la naranja (Zegada, 2015), cascarilla de cacao (Tapia, 2015), corteza de mango (Fustamante y Valdera, 2019), piña (Ávila, 2019) y pulpa de café (Serrat et al., 2018).
La composición de las cáscaras de frutos puede variar, sin embargo, generalmente pueden encontrarse polisacáridos complejos como la celulosa (carbohidrato más abundante, formando entre el 40 – 60% de la pared de las plantas), hemicelulosa (30%), lignina, así como otros polisacáridos mucilaginosos. Varias investigaciones evidencian, que es posible la extracción de pectina empleando cortezas residuales mediante hidrólisis ácida, obteniéndose rendimientos y calidad aceptables. La pectina, es un polisacárido empleado como aditivo natural en diversas industrias de alimentos, como gelificante, espesante, estabilizante y emulsificante, para obtener bebidas lácteas, bocadillos, dulces, galletas, gelatinas, gomitas, helados, mermeladas, postres, yogur, entre otros (Moreno, 2018).
Del cambur se consume directamente la pulpa de la fruta fresca cuando ha alcanzado un nivel de maduración o mediante su procesamiento para obtener productos alimenticios, en ambos casos, queda la cáscara como un residuo (Arellanes et al., 2011). Sin embargo, es posible la utilización de la cáscara de este fruto como soporte para la extracción de pectina, considerándolo como una vía alternativa a los ya existentes, a la vez que favorece el aprovechamiento de este residuo con la minimización de contaminación.
A nivel industrial, las pectinas son extraídas de la pulpa de manzana, cáscaras de frutos cítricos principalmente naranja y limón, así como, residuos de la industria azucarera (remolacha), y aceitera (girasol) entre otras plantas (Pérez et al., 2012). El requerimiento de pectinas en el mundo está en constante incremento, sobrepasando las 20,000 toneladas por año (Arellanes et al., 2011). La exigencia de tal insumo en la industria alimentaria, hace que la búsqueda de materia primas alternativas y rentables, sea una tarea incesante para la ciencia, particularmente en aquellos países con elevado consumo y altos niveles de importación de éste producto, de allí la imperiosa necesidad de evaluar recursos vegetales residuales no tradicionales generados del consumo comercial.
En evidencia de la potencialidad de las cáscaras de frutos, se planteó una investigación con el objetivo de extraer de pectina mediante hidrolisis ácida de la cáscara de cambur (Musa paradisiaca).
Materia prima
Los frutos de cambur, fueron cosechados de los cultivos de la población San Luis, municipio Bolívar, estado Falcón, Venezuela. La cáscara, se tomó a partir de 30 kilogramos de frutos frescos, agrupados en racimos, en su estado de madurez de consumo, de color amarillo uniforme, buen estado físico y sin daños biológicos (sin hongos ni descomposición).
Preparación del material
Se empleó la metodología reportada por Arellanes (2011) y Arrazola et al. (2016). Se lavaron los frutos con agua y se desinfectaron con agua clorada, se separó la cáscara de la pulpa interior cortandose la cáscara a trozos de tamaño de 2 a 5cm. Para prevenir el pardeamiento enzimático, se realizó un tratamiento de escaldado de la corteza con solución de ácido cítrico (5% m/v) a temperatura ambiente por 30 minutos. Posteriormente, se escurrieron, molieron y secaron a temperatura de 60ºC por un tiempo de 24 horas hasta humedad del 10%. Luego se pulverizó y se almacenó en bolsas herméticas (Zegada, 2015).
Métodos analíticos de caracterización de la materia prima
A la cáscara de cambur en su estado inicial se le determinaron de sus parámetros fisicoquímicos (por triplicado) tomando aplicando metodologías normalizadas (Tabla 1).
Tabla 1.
Métodos normalizados para el análisis fisicoquímico.
|
Parámetros |
Normas de referencia |
|
Humedad |
COVENIN 1156-79 |
|
Sólidos totales |
COVENIN 1945-82 |
|
pH |
COVENIN 1315-79 |
|
Proteína cruda |
AOAC, 2057 |
|
Extracto etéreo |
COVENIN 1785--81 |
|
Azúcares totales |
COVENIN 1301-83 |
|
Azucares Solubles |
COVENIN 924-83 |
|
Cenizas totales |
COVENIN 1155 – 79 |
Extracción de pectina por hidrólisis ácida a condiciones de referencia y diseño de experimentos
Se realizó según metodologías referenciadas (Moreno et al., 2017; Curbelo et al., 2017; y Zegada, 2015). En un beaker de 500mL, se colocaron 30 gramos de la cáscara de cambur pre-tratada y seca, se le adicionó 200mL de agua destilada y se agitó. Se utilizó ácido clorhídrico concentrado para ajustar el pH y diferentes temperaturas y tiempos (tabla 2). La mezcla experimental se agitó constantemente durante la hidrólisis y al terminar el tiempo, se filtró el residuo con un liencillo y el líquido obtenido se enfrió a temperatura ambiente. Al líquido, se le adicionó etanol absoluto en proporción 1:1,5 y agitó constantemente, dejando en reposo por 12 horas para precipitar la pectina como un sólido gelatinoso, se filtró nuevamente. El producto se secó en una estufa a una temperatura de 60ºC. Finalmente, se realizó la molienda de la pectina hasta un fino polvo.
Se realizó un diseño experimental aleatorio, empleando tres factores: pH, tiempo y temperatura, cada uno con tres niveles (Tabla 2), lo cual permitió un arreglo factorial 33. Como variable respuesta se estableció el rendimiento de pectina extraída.
Tabla 2.
Factores y niveles para la extracción de pectina.
|
|
Niveles |
||
|
Factores |
Bajo |
Medio |
Alto |
|
pH |
2 |
2,5 |
3 |
|
Tiempo (min) |
45 |
60 |
75 |
|
Temperatura (ºC) |
80 |
85 |
90 |
Métodos analíticos de caracterización de pectina
Se determinó la calidad de la pectina extraída mediante indicadores de pureza y propiedades gelificantes (Tabla 3), lo cual define el buen desempeño de la pectina para la elaboración de productos (Zegada, 2015).
Tabla 3.
Métodos normalizados para la caracterización fisicoquímica de la pectina.
|
Parámetros |
Método |
Referencia |
|
Contenido metóxilo |
Volumétrico Titulación con NaOH
|
Mendoza et al., (2017) |
|
Ácido galacturónico |
||
|
Grado de esterificación |
Los resultados derivados de los ensayos de laboratorio de la extracción de la pectina se procesaron estadísticamente mediante un análisis de varianza, para determinar la significancia de los factores experimentales de acuerdo a sus niveles, mediante el empleo del paquete estadístico Statgraphic Centurión XV, versión 15.2.06.
Caracterización fisicoquímica de la cáscara de cambur
En la tabla 4, se presentan los resultados de la caracterización fisicoquímica y se comparan con otros soportes utilizados con el mismo fin.
Tabla 4.
Características fisicoquímicas de la materia prima y comparación.
|
|
|
Referencia comparativa |
|||
|
Parámetros |
Cáscara de Cambur |
Cáscara de Mango1 |
Cáscara de Naranja2 |
Cáscara de Cacao3 |
Bagazo de sabila4 |
|
Humedad (%) |
89,8±0,4 |
80,00±2,0 |
85,9 ± 1,6 |
8,17±0,52 |
5,926 ± 0,868 |
|
pH |
4,8±0,3 |
- |
3,93 ± 0,03 |
- |
6,438 ± 0,0104 |
|
Proteína cruda (%) |
4,3±0,5 |
0,50±0,1 |
6,16 ± 0,23 |
4,59±0,52 |
0,701 ± 0,0150 |
|
Extracto etéreo (%) |
5,5±0,3 |
0,14±0,1 |
1,55 ± 0,17 |
0,60±064 |
- |
|
Azúcares totales (%) |
12,7±0,2 |
9,33±1,53 |
3,8 ± 0,3 |
45,52 |
- |
|
Azúcares Solubles (°Brix) |
5,5±0,08 |
- |
7,1 ± 1,2 |
- |
- |
|
Cenizas totales (%) |
13,46±0,07 |
9,17±0,76 |
3,29 ± 0,19 |
8,59±0,07 |
4,918 ± 1,565 |
Fuentes: 1- Cascara de mango: Fustamante y Valdera (2019); 2- Cáscara de naranja: Cerón et al. (2011); 3- Cáscara de cacao: Castillo et al. (2018); Bagazo de sábila: Moreno et al. (2017); (-) No reportado por los autores.
El contenido de humedad en la cáscara de cambur es alto, respecto a los demás materiales, debido a la húmeda natural de la muestra. Una humedad inferior al 10% previene el deterioro del material, minimizando la actividad enzimática y microbiológica que pueden deteriorar la composición estructural (hidratos de carbono y pectina) (Prescott et al., 1999), por tal razón, se aplicó un secado a la cáscara de cambur. El pH es ácido, y el resultado es mayor al reportado en la cáscara de naranja pero menor al del bagazo de sábila. El mismo es atribuible a los ácidos galaturónicos, unidad básica de todas las sustancias pécticas (Rodríguez y Zepeda, 2016).
La proteína cruda, se encuentra en el intervalo de los materiales referenciados, indicando el valor nutritivo como fuente de alimentación (Saenz, et al., 2006). El extracto etéreo, es alto respecto a los citados. En investigaciones enfocadas a la obtención de pectina, no señalan ningún efecto de la fracción lipídica en su extracción. El contenido de azúcares totales, es superior al reportado en las referencias, a excepción de la cáscara de cacao. Este parámetro es un indicativo de los hidratos de carbono que se pueden relacionar indirectamente al contenido de pectina y otros polisacáridos complejos (Saavedra, 2015).
El contenido de sólidos solubles, es menor al existente en la cáscara de naranja, los demás soportes no reportan resultados en este parámetro. Éste parámetro, indica la calidad del material para la extracción de pectina según el nivel de maduración. Se obtiene un valor bajo, debido a su nivel de madurez intermedio lo cual puede ser adecuado para obtener rendimientos en pectina moderados. Este parámetro aumenta con la madurez del fruto y la pectina muestra degradación, afectando el rendimiento a niveles mínimos, por lo tanto, los valores más bajos corresponden a frutos verdes mostrando mejores resultados de extracción de pectina (Chaparro, 2015). El contenido de ceniza representa fracción mineral contenida en la corteza de cambur y depende de las condiciones del terreno de cultivo de la planta (Zúñiga y Gutiérrez, 2010). El resultado, es superior a los determinados en materiales utilizados para los mismos fines extractivos. Las cenizas, pueden afectar la capacidad de esta sustancia para gelificarse (Miyamoto y Chang, 1992).
Los resultados del análisis fisicoquímico de la cáscara de cambur, deja en evidencia que es un soporte con condiciones adecuadas para ser utilizado para obtener pectina.
Obtención de pectinas mediante hidrolisis ácida
El análisis estadístico de los resultados ANOVA) determinó con un nivel de confianza del 95%, que la temperatura, el pH, el tiempo y las interacciones de pH y pH- tiempo tienen valor p<0,05, por lo tanto, son significativos (tabla 5).
Tabla 5.
Análisis de varianza (ANOVA) para la extracción de pectina de la cáscara de cambur.
|
Fuente |
Suma de Cuadrados |
Gl |
Cuadrado Medio |
Razón-F |
Valor-P |
|
|
A:pH |
107,744 |
1 |
107,744 |
225,39 |
0,0000 |
|
|
B:Tiempo |
8,132 |
1 |
8,132 |
17,01 |
0,0002 |
|
|
C:Temperatura |
213,793 |
1 |
213,793 |
447,23 |
0,0000 |
|
|
AA |
2,19593 |
1 |
2,19593 |
4,59 |
0,0373 |
|
|
AB |
4,36054 |
1 |
4,36054 |
9,12 |
0,0041 |
|
|
Bloques |
0,0000907407 |
1 |
0,0000907407 |
0,00 |
0,9891 |
|
|
Error total |
22,4677 |
47 |
0,478036 |
|
|
|
|
Total (corr.) |
358,694 |
53 |
|
|
|
|
|
|
||||||
|
R-cuadrada (%) |
93,7363 |
|||||
|
Estadístico Durbin-Watson |
2,48329 (P=0,9301) |
|||||
En la tabla 6, se presentan los resultados detallados de los rendimientos de pectina. Las condiciones de extracción tabuladas, se refieren a las estadísticamente significativas según el ANOVA (P<0,05).
Tabla 6.
Rendimiento de pectina a las condiciones estadísticamente significativas (T=85 °C).
.
|
pH |
Tiempo (min) |
Promedio (%) ± Desviación est. |
|
2 |
45 |
12,77±0,20 |
|
60 |
13,20±0,04 |
|
|
75 |
13,87±0,11 |
|
|
2,5 |
45 |
11,11±0,03 |
|
60 |
11,88±0,017 |
|
|
75 |
12,17±0,08 |
|
|
3 |
45 |
10,37±0,04 |
|
60 |
10,93±0,07 |
|
|
75 |
11,23±0,04 |
En la tabla 6 se observa con referencia a la temperatura de 85 ºC, un rendimiento mínimo de 10,37% a pH 3 y t= 45 min y máximos de 13,87% a pH 2 y t= 75 min. Con base a estos resultados, se precisa que al aumentar el pH disminuye el rendimiento, así mismo al aplicar mayores tiempos en la hidrólisis. Éste comportamiento fue similar al obtenido por Fustamante y Valdera (2019).
El diagrama de Pareto (Figura 1), muestra la influencia significativa y positiva de la temperatura, tiempo y la interacción cuadrática del pH sobre el rendimiento. En este sentido, un aumento en estos factores influye en un mayor rendimiento de pectina que se puede extraer de la corteza de cambur. En la misma figura, se evidencia el efecto negativo en la variable respuesta del pH y las interacciones pH y tiempo, esto significa que al aumentar los niveles se precisaran menores rendimientos.
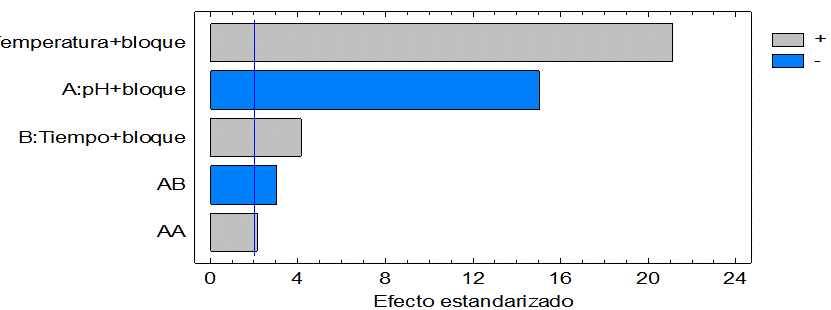 |
Figura 1.
Diagrama de Pareto para la hidrolisis de la cáscara de cambur.
Con los resultados obtenidos, se planteó un modelo matemático con los efectos significativos codificados (p<0,05), para predecir el rendimiento de pectina:
Rendimiento= -21,0681 - 8,60556*pH + 0,173769*Tiempo + 0,487389*Temperatura + 1,71111*pH^2 - 0,0568333*pH*Tiempo (Ec. 1)
La variable con mayor coeficiente en el modelo, tiene mayor incidencia en el rendimiento de pectina. En este sentido, se muestra que la temperatura es la que afecta en mayor medida los resultados experimentales y en segundo lugar el tiempo.
En el gráfico de efectos de los factores (Figura 2) se muestra, como la temperatura y pH tienen mayor influencia sobre la variable respuesta, en tanto, el tiempo, es ligeramente significativo. Asimismo, se aprecia un máximo rendimiento a estas condiciones con un valor promedio de 13,87%.
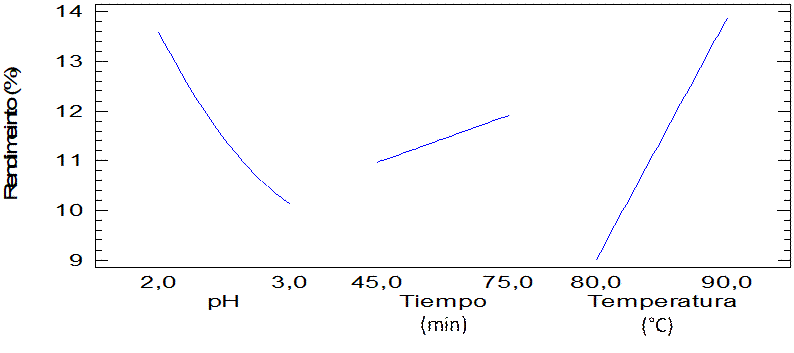 |
Figura 2.
Efectos de los factores en la hidrolisis de la cascara de cambur.
En el gráfico de la superficie de respuesta (Figura 3), se precisan las condiciones que maximizan el rendimiento de pectina. De allí que el vértice de la malla muestra su mayor inclinación en el eje de rendimiento a una temperatura de 85ºC, reportando un 13,87% a pH 2 y 75 minutos, evidenciando las mejores condiciones de extracción. El vértice inferior, está cercano a un tiempo de 45 min y pH=3 refiriendo un rendimiento de 10,37%. Se observa un ligero efecto del tiempo a pH= 3, en tanto, el rendimiento en función del pH, muestra una pendiente inclinada, lo que indica su influencia en la extracción.
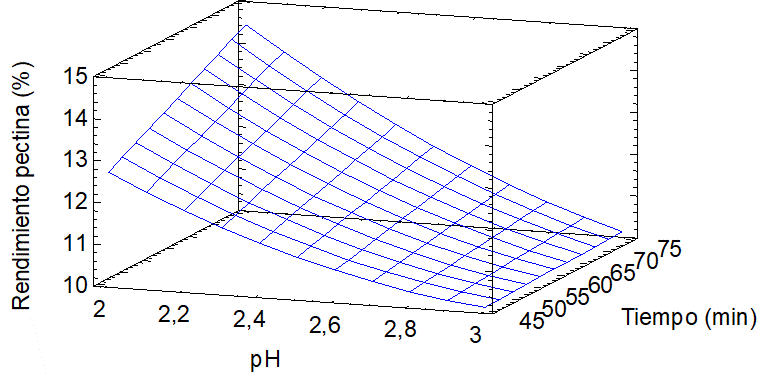
Figura 3.
Superficie de respuesta del rendimiento de pectina en la hidrolisis (T=85ºC).
Análisis de la influencia de las condiciones de extracción de la pectina
Las temperaturas en la extracción de pectina están en un intervalo de 40 y 120°C (Zegada, 2015). La temperatura, conlleva al mayor rompimiento de enlaces de la protopectina, a partir en hidrólisis se obtienen las pectinas (Barazarte et al., 2008). Betancourt y Llano (2009), señalan que el calentamiento inhibe la acción de las enzimas pectinoléicas y microorganismos de la materia prima, que degradan las protopectinas y pectinas de la pared celular, también genera un ablandamiento del material facilitando la extracción.
Por su parte, tiempos prolongados en el calentamiento durante la hidrólisis, puede aumentar el rendimiento de la pectina y el grado de metoxilación (Betancourt y Llano, 2009), porque se libera del tejido vegetal la pectina soluble (ácido urónico), sin degradar su estructura. El control del tiempo es una variable crítica, un aumento desproporcionado afecta el grado de metoxilación, por que puede fraccionar la pectina en las uniones metil-éster de los monómeros. Ávila (2019), señala que tiempos mayores incrementan el rendimiento ya que la hidrólisis se completa.
El pH ácido, maximiza la hidrólisis de la protopectina y la exposición de la pectina al solvente, con ello hay un menor consumo de alcohol en la precipitación y mejor rendimiento y calidad de pectina (Seixas et al., 2014).
Evaluación del rendimiento y calidad de la pectina obtenida
La Tabla 7, reporta los rendimientos y las características fisicoquímicas de la pectina, y se compara con resultados obtenidos en investigaciones de la misma temática.
Tabla 7.
Rendimientos de la pectina extraída, parámetros de calidad y comparación con reportadas en investigaciones.
|
|
|
Referencia comparativa |
||||
|
Parámetros |
1 |
2 |
3 |
4 |
5 |
6 |
|
Rendimiento (%) |
13,87±0,11 |
11 |
49,7 |
23,04 |
11,45 |
- |
|
Contenido metóxilo (%) |
12±3 |
5.75 |
1,80 |
2,89 |
14,88 |
<6,70 |
|
Ácido galacturonico (%) |
79±3 |
- |
37,11 |
78,19 |
68,64 |
< 65 |
|
Grado de esterificación (%) |
89,02±0,01 |
63.00 |
72,43 |
63,45 |
61,43 |
81,5 |
Fuentes: 1- Cáscara de cambur; 2- Cáscara de mango (Fustamante y Valdera, 2019); 3- Cáscara de naranja (Ceron et al., 2011); 4- Cáscara de cacao (Cobenas et al. 2018); 5 Bagazo de sábila (Moreno et al., 2017) 6- Pectina comercial. (Food Chemicals Codex (FCC); U.S. Pharmacopeial Convention (USP); – No reportado por los autores.
El rendimiento de pectina de la cáscara de cambur, es inferior al obtenido en cáscara de naranja y cáscara de cacao, pero es mayor al reportado en la cáscara de mango y del bagazo de sábila. Las diferencias, pueden obedecer a la naturaleza de cada soporte vegetal, nivel de maduración, grado de subdivisión de la materia, pretratamientos del material, condiciones operacionales de extracción o agentes acidificantes empleados, los cuales pudieron diferir uno del otro.
Las propiedades fisicoquímicas de las pectinas se relacionan con la función que desarrollan como fibra y como agente espesante en los alimentos (Chasquibol et al., 2008). De acuerdo al contenido de metóxilo, el logrado en la pectina obtenida de la corteza de cambur supera al presentado en los materiales reportados como referencia, a excepción del bagazo de sábila, en tal sentido, ambos productos se clasifican como pectina de alto metóxilo. Según Moreno et al., (2018), las pectinas con un contenido de metóxilo en un intervalo de 7 a 12%, es soluble en iones calcio y puede gelificar en presencia de azúcares y ácidos en condiciones que pueden requerir de 60-65% de sólidos solubles (azúcar) y 2,7-3,2 de pH.
El contenido de ácido galacturónico existente en la pectina extraída de la cáscara de cambur es alto en comparación al de la cáscara de naranja y referencia estándar, pero similar al de la cáscara de cacao. De acuerdo a estos resultados, la pectina obtenida presenta mayor pureza y es de gelificación rápida. Según Pagán (1995), las elevadas cantidades ácido galacturónico en la pectina, se relacionan con la pureza.
El grado de esterificación de la pectina, es mayor en comparación a las referenciadas. Por lo que, a mayor grado de esterificación, la pectina será soluble en agua y mostrará una gelificación rápida (Curbelo et al., 2017). Este parámetro, es un indicador de predicción de la fuerza y el tipo de gel, además que a mayor grado de esterificación mayor serán las interacciones hidrofóbicas y el gel será más fuerte.
CONCLUSIONES
La cáscara de cambur es un soporte con características fisicoquímicas ajustadas al de otras cortezas empleadas para la extracción de pectinas, lo que resulta adecuada para la extracción del componente gelificante, aplicando hidrolisis ácida a una temperatura de 85ºC, pH igual a 2 y un tiempo de 75 min para un rendimiento de 13,87%. La pectina extraída, es de alto metoxilo y gelificación rápida siendo recomendable su uso en el procesamiento de mermeladas.
FINANCIAMIENTO
No monetario.
AGRADECIMIENTO
A la Universidad Nacional Experimental Francisco de Miranda y al Centro de Investigaciones Tecnológicas (CITEC); por apoyar la Investigación.
REFERENCIAS
Association Official Analytical Chemist. (1980). Official Methods of Analysis (AOAC-2057). Determination of crude protein. Washingtong, EEUU.
Arellanes, A.; Jaraba, Z.; Mármol, G.; Páez, G.; Aiello, C. y Rincón, M. (2011). Obtención y caracterización de pectina de la cáscara del cambur manzano (Musa AAB). [Obtaining and characterizing pectin from banana peel (Musa ABB)]. Revista Facultad de agronomía (LUZ), 28(4), 523-539. https://n9.cl/vfwp1
Arrázola, G.; Alvis, A., Mogollón, C. (2016). Efecto del tratamiento de escaldado sobre la actividad enzimática de la polifenoloxidasa en dos variedades de batata (Ipomoea batatas Lam.). [Effect of blanching treatment on the enzymatic activity of polyphenoloxidase in two varieties of sweet potato (Ipomoea batatas Lam.)] Revista colombiana de ciencias hortícolas, 10(1), 80-88. https://n9.cl/c4dya
Ávila, E. (2019). Extracción y caracterización de pectina a partir de residuos de cáscaras de piña (Ananas comosus) por el método de hidrólisis ácida. [Extraction and characterization of pectin from pineapple (Ananas comosus) peel residues by the acid hydrolysis method] (tesis de postgrado). Universidad Nacional Abierta y a Distancia, Acacias. https://n9.cl/3yf6d
Barazarte, H.; Sangronis, E. y Unai, E. (2008). La cáscara de cacao (Theobroma cacao L.): Una posible fuente comercial de pectinas. Cocoa shell (Theobroma cacao L.): A possible commercial source of pectins]Archivos Latinoamericano de Nutrición, 58(1), 64-70. https://n9.cl/3jbq5
Betancourt, L. y Llano, J. (2009). Extracción de pectinas a partir de los subproductos del beneficio del cacao. [Extraction of pectins from the by-products of cocoa processing] (tesis de pregrado). Universidad EAFIT, Medellín, Colombia. https://n9.cl/q2fx5
Castillo, E.; Alvárez, C. y Contreras, Y. (2018).Caracterización fisicoquímica de la cáscara del fruto de un clon de cacao (Theobroma cacao l.) cosechados en Caucagua estado Miranda. Venezuela. [Physicochemical characterization of the fruit shell of a cocoa clone (Theobroma cacao l.) harvested in Caucagua, Miranda state. Venezuela]. Revista de Investigación Universidad Pedagógica Experimental Libertador, 42(95), 154-175, https://n9.cl/ak2vu
Cerón, I. y Cardona, C. (2011). Evaluación del proceso integral para la obtención de aceite esencial y pectina a partir de la cáscara de naranja. [Evaluation of the integral process to obtain essential oil and pectin from orange peel]. Revista Ingeniería y Ciencia, 7(13), 65-86. https://n9.cl/ezpm5
Chaparro, S.; Márquez, R.; Sánchez, J.; Vargas, M. y Gil, J., (2015). Extracción de pectina del fruto del higo (Opuntia ficus indica) y su aplicación en un dulce de piña. [Extraction of pectin from the fruit of the fig (Opuntia ficus indica) and its application in a pineapple sweet]. Revista U.D.C.A Actualidad & Divulgacion Cientifica 18(2), 435-443. https://n9.cl/zb2gc
Chasquibol, N.; Arroyo, E.; y Morales, J. (2008). Extracción y caracterización de pectinas obtenidas a partir de frutos de la biodiversidad peruana. [Extraction and characterization of pectins obtained from the fruits of Peruvian biodiversity]. Revista Ingeniería Industrial, (26), 175-199. https://n9.cl/1zswu
Cobeñas, S. y Guerrero J. (2018). Caracterización de la pectina obtenida a partir de la cascara de cacao (Theobroma cacao L.) mediante variación del ácido y temperaturas. [Characterization of pectin obtained from cocoa shells (Theobroma cacao L.) by varying acid and temperatures] (tesis de pregrado). Universidad Nacional de Tumbes. Tumbes, Perú. https://n9.cl/k10f7
Comisión Venezolana de Normas Industriales. (1979). Alimentos. Determinación de humedad, (Norma 1156-79). [Foods. Determination of Humidity, (Standard 1156-79)]. SENCAMER, Venezuela. https://n9.cl/uh1r0
Comisión Venezolana de Normas Industriales. (1979). Leche y sus derivados. Determinación de humedad/solidos totales (Norma 1945-82). [Milk and its derivatives. Determination of Moisture / total solids (Standard 1945-82)]. SENCAMER, Venezuela. https://n9.cl/r9pt7
Comisión Venezolana de Normas Industriales. (1979). Alimentos. Determinación del pH (Norma 1315-79). [Foods. pH determination (Standard 1315-79)]. SENCAMER, Venezuela. https://n9.cl/hepsga
Comisión Venezolana de Normas Industriales. (1981). Alimentos. Determinación de extracto etéreo (Norma 11785-81). [Foods. Determination of ethereal extract (Standard 11785-1)]. SENCAMER, Venezuela. https://n9.cl/3bqmw
Comisión Venezolana de Normas Industriales (1983). Jugos y néctares, Determinación de azúcares (Norma 1301-83). [Juices and nectars. Determination of sugars (Standard 1301-83)]. SENCAMER, Venezuela. https://n9.cl/fsqcp7
Comisión Venezolana de Normas Industriales (1983). Frutos y productos derivados, Determinación de azucares solubles por refractometria (Norma 924-83). [Fruits and derived products. Determination of soluble sugars by refractometry (Standard 924-83)]. SENCAMER, Venezuela. https://n9.cl/uxann
Comisión Venezolana de Normas Industriales. (1979). Alimentos. Determinación de cenizas (Norma 1155-79). [Foods. Determination of ashes (Standard 1155-79)]. SENCAMER, Venezuela. https://n9.cl/n1eyl
Cúrbelo, C.; Moreno, M.; Ramírez, D. y Crespo, L. (2017). Hidrólisis ácida del bagazo de Aloe vera (sábila) para la obtención de pectina. [Acid hydrolysis of Aloe vera bagasse (sabila) to obtain pectin]. Revista Centro Azúcar, 44(2), 18-26, https://n9.cl/crg4x
Food Chemicals Codex, FCC. (1931). Specifications for commercial pectins. https://n9.cl/wym62
Fustamante, Y. y Valdera, W., (2019). Extracción enzimática y caracterización de la pectina a partir de los residuos del mango (Mangifera indica); Lambayeque 2015. [Enzymatic extraction and characterization of pectin from mango residues (Mangifera indica); Lambayeque 2015] (tesis de pregrado). Univerisidad Señor Sipan, Peru. https://n9.cl/zzi4r
Mendoza, L.; Jiménez, J. y Ramírez, M. (2017). Evaluación de la pectina extraída enzimáticamente a partir de las cáscaras del fruto de cacao (Theobroma cacao l.). [Evaluation of pectin extracted enzymatically from cocoa fruit shells (Theobroma cacao l.)]. Revista U.D.C.A Actualidad & Divulgación Científica 20(1),131–138. https://n9.cl/3b9n1
Miyamoto, A. & Chang, K. (1992). Extraction and physicochemical characterization of pectin from sunflower head residues. Journal of Food Science 57(6), 1439-1443. https://n9.cl/wk58c
Moreno, M.; Crespo, L. y Quintero, M. (2018). Extracción de pectina de las vainas de Moringa oleifera y su aplicación en una mermelada. [Extraction of pectin from the pods of Moringa oleifera and its application in a jam]. Revista Monteverdia 11(2), 1-9. https://n9.cl/2t2ld
Moreno, M.; Gutiérrez, J.; Márquez, D. y Heredia, N. (2017). Evaluación del bagazo de sábila para la extracción de pectina a escala de laboratorio. [Evaluation of laboratory bagazo for the extraction of pectin to laboratory scale]. Cienciamatria Revista Interdisciplinaria de Humanidades, Educación, Ciencia y Tecnología, 3(5), 117-132. https://n9.cl/gza7w
Pagan, J. (1995). Degradación enzimática y características físicas y químicas de la pectina del bagazo de melocotón. [Enzymatic degradation and physical and chemical characteristics of pectin from peach bagasse] (tesis de postgrado), Universitat de Lleida. https://n9.cl/5bjmy9
Pérez, W.; Urrego, P.; Silva, D. y Mojica, J. (2012). Obtención y caracterización de pectina a partir de residuos de la agroindustria vitivinícola del departamento de Boyacá. [Obtaining and characterizing pectin from waste from the wine industry in the Department of Boyacá]. Journal of Bioscience and Biotechnology, 1(3), 223-233. https://n9.cl/3xcfo
Prescott, L.; Harley, J. y Klein, D. (1999). Microbiología. [Microbiology]. (4ta Edición). España, Mc Graw Hill Interamericana de España.
Rodríguez, C. y Zepeda, V. (2016). Aprovechamiento de la cáscara de cacao (Theobroma Cacao L.): Extracción de pectina para elaboración de mermelada. [Use of cocoa shells (Theobroma Cacao L): Extraction of pectin for jam production] (tesis de pregrado). Universidad Dr. José Matías Delgado, El Salvador. https://n9.cl/623sk
Saavedra, L. (2015). Uso integral del maracuyá (Passiflora edulis flavicarpa) en la extracción de pectina y formulación de mermeladas. [Comprehensive use of passion fruit (Passiflora Edulis flavicarpa) in pectin extraction and jam formulation] (tesis de pregrado). Universidad Central del Ecuador. https://n9.cl/lwcyd
Sáenz, C.; Berger, H.; Corrales, G.; Galletti, L.; García, V. e Higuera, I., (2006). Utilización agroindustrial del nopal. [Agroindustrial use of nopal]. Boletín de Servicios Agrícolas de la FAO, (162), 35-46. https://n9.cl/9lexk
Seixas, F.; Fukunda, D.; Turbiani, F.; García, P.; Petkowicz, C.; Jagadevan, S. & Gimenes, M. (2014). Extraction of pectin from passion fruit peel (Passiflora edulis f. flavicarpa) by microwave-induced heating. Journal Food Hydrocolloids, 38, 186-192. https://n9.cl/scc14
Serrat, M.; De la Fé, A.; De la Fé, J. y Montero, C. (2018). Extracción y caracterización de pectina de pulpa de café de la variedad robusta. [Extraction and characterization of pectin from robusta variety coffee pulp]. Revista cubana de Química, 30(3), 552-538. https://n9.cl/fj4ol
Vargas Y. y Pérez L. (2018). Aprovechamiento de residuos agroindustriales en el mejoramiento de la calidad del ambiente. [Use of agro-industrial residues in the improvement of the quality of the environment]. Revista Facultad de Ciencias Básicas, 14(1), 59-72. https://n9.cl/a33mb
Zegada, V. (2015). Extracción de pectina de residuos de cáscara de naranja por hidrólisis ácida asistida por microondas (HMO). [Extraction of pectin from orange peel residues by microwave-assisted acid hydrolysis (HMO)]. Revista Investigación & Desarrollo, 1(15), 65-76. https://n9.cl/e7icw
Zúñiga, P. y Gutiérrez, R. (2010) Evaluación nutrimental del residuo obtenido de la molienda húmeda de cebada. [Nutritional evaluation of the residue obtained from the wet milling of barley]. XII Congreso Nacional de Ciencia y Tecnología de Alimentos. Universidad de Guanajuato. México. pp.1-10. https://n9.cl/3xcfo
©2021 por el autor. Este artículo es de acceso abierto y distribuido según los términos y condiciones de la licencia Creative Commons Atribución-NoComercial-CompartirIgual 4.0 Internacional (CC BY-NC-SA 4.0) (https://creativecommons.org/licenses/by-nc-sa/4.0/).